Resumen: Los investigadores han identificado un grupo de mutaciones genéticas que protegen contra el deterioro cognitivo en adultos mayores. Un nuevo estudio sugiere que la presión selectiva de patógenos infecciosos como la gonorrea puede haber potenciado la aparición de esta variación genética en el Homo sapiens.
fuente: Universidad de California
Investigadores de la Facultad de Medicina de la Universidad de California en San Diego han encontrado previamente un grupo de mutaciones genéticas humanas que protegen a los adultos mayores del deterioro cognitivo y la demencia.
En un nuevo estudio publicado el 9 de julio de 2022 en Biología molecular y evolución.Se centran en uno de estos genes mutantes e intentan rastrear su evolución : cuándo y por qué apareció en el genoma humano.
Los resultados sugieren que la presión selectiva de patógenos infecciosos como la gonorrea puede haber potenciado la aparición de esta variante genética en hombre cuerdoy sin querer apoyó la existencia de ancestros en la sociedad humana.
La biología de la mayoría de las especies animales se ha mejorado para la reproducción, a menudo a costa de una salud futura y una vida más larga. De hecho, los humanos son una de las únicas especies conocidas que han pasado por la menopausia.
Según la «hipótesis de la abuela», esto se debe a que las mujeres mayores brindan un apoyo importante en la crianza de los bebés y niños, que necesitan más cuidados que los más jóvenes de otras especies. Los científicos ahora están tratando de comprender las características de la biología humana que hacen posible esta salud a largo plazo.
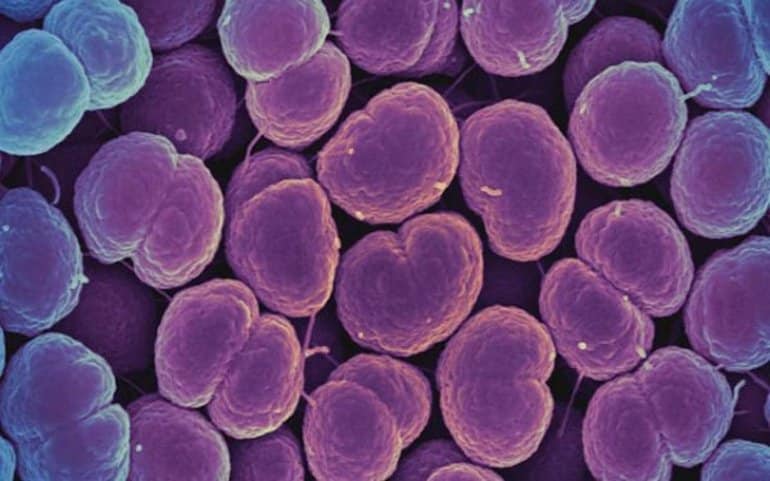
Cuando los investigadores compararon previamente los genomas de humanos y chimpancés, encontraron que los humanos tienen una copia única del gen CD33, un receptor expresado en las células inmunitarias. El receptor CD33 estándar se une a un tipo de azúcar llamado ácido siálico con el que están recubiertas todas las células humanas. Cuando la célula inmunitaria detecta el ácido siálico a través de CD33, reconoce a la otra célula como parte del cuerpo y no la ataca, evitando la respuesta autoinmune.
El receptor CD33 también se expresa en células inmunitarias del cerebro llamadas microglia, donde ayudan a controlar la neuroinflamación. Sin embargo, la microglía también tiene un papel importante en la eliminación de las células cerebrales dañadas y las placas amiloides asociadas con la enfermedad de Alzheimer. Al unirse a los ácidos siálicos en estas células y placas, los receptores CD33 normales en realidad inhiben esta importante función glial y aumentan el riesgo de demencia.
Aquí es donde entra la nueva variante genética. En algún lugar a lo largo de la línea evolutiva, los humanos han adquirido una forma mutada adicional de CD33 a la que le falta un sitio de unión al azúcar. El receptor mutado ya no interactúa con los ácidos siálicos en las células y placas dañadas, lo que permite que la microglía las descomponga. De hecho, se descubrió que niveles más altos de esta variante de CD33 protegen contra la enfermedad de Alzheimer de inicio tardío.
En un esfuerzo por comprender cuándo apareció por primera vez esta variante genética, el coautor principal Ajit Varkey, MD, Profesor Distinguido de Medicina y Medicina Celular y Molecular en la Facultad de Medicina de la Universidad de California en San Diego, y sus colegas encontraron evidencia de una fuerte selección positiva, lo que sugiere que algo estaba impulsando la evolución del gen más rápido de lo esperado.
También descubrieron que esta copia particular de CD33 no estaba presente en los genomas de los neandertales o los denisovanos, nuestros parientes evolutivos más cercanos.
«Para la mayoría de los diferentes genes en humanos y chimpancés, los neandertales generalmente tienen la misma versión que los humanos, por lo que esto fue realmente sorprendente para nosotros», dijo Varkey. «Estos hallazgos sugieren que la sabiduría y el cuidado de los ancestros sanos pueden haber sido una importante ventaja evolutiva que tuvimos sobre otras especies de homínidos antiguos».
Varkey dirigió el estudio con Pascal Gagnoux, PhD, profesor de patología en la Facultad de Medicina de San Diego de la Universidad de California y profesor en el departamento de antropología. Los autores dijeron que el estudio proporciona nueva evidencia que respalda la hipótesis de la novedad.
Sin embargo, la teoría evolutiva dice que el éxito reproductivo es el principal impulsor de la selección genética, no la salud cognitiva posreproductiva. Entonces, ¿qué provocó la propagación de esta forma mutada de CD33 en humanos?
Los autores sugieren que una posibilidad es que enfermedades altamente contagiosas como la gonorrea, que pueden ser dañinas para la salud reproductiva, puedan tener un impacto en el desarrollo humano. Las bacterias de la gonorrea se encapsulan con los mismos polisacáridos a los que se une el receptor CD33. Como un lobo con piel de oveja, las bacterias pueden engañar a las células inmunitarias humanas para que no las reconozcan como invasores externos.
Los investigadores sugieren que la versión modificada de CD33 sin un sitio de unión al azúcar surgió como una adaptación humana contra el «mimetismo molecular» de la gonorrea y otros patógenos. De hecho, confirmaron que una de las mutaciones específicas de los humanos pudo anular por completo la interacción entre la bacteria y el CD33, lo que permitió que las células inmunitarias atacaran nuevamente a la bacteria.
En conjunto, los autores creen que los humanos heredaron inicialmente la forma mutada de CD33 para protegerse contra la gonorrea durante la edad fértil, y el cerebro seleccionó posteriormente esta variante genética por sus beneficios contra la demencia.
«Es probable que CD33 sea uno de varios genes que se seleccionaron por sus ventajas de supervivencia frente a patógenos infecciosos en etapas tempranas de la vida, pero luego se seleccionan de forma secundaria por sus efectos protectores contra la demencia y otras enfermedades asociadas con el envejecimiento», dijo Gagnox.
Los coautores son: Sudeshna Saha, Nazanin Khan, Andrea Verhagen, Aniruda Sasmal, Sandra Diaz en UCSD, Troy Comey, Joshua M. Aki en la Universidad de Princeton, Hai Yu y Shi Chin en UC Davis, y Martin Frank en Biognos A. con yo. .
Financiación: Este trabajo fue financiado por los Institutos Nacionales de Salud (Subvención R01GM32373) y el Fondo para el Tratamiento del Alzheimer.
Sobre esta noticia de genética y neurociencia evolutiva
autor: scott la vi
fuente: Universidad de California
Contacto: Scott La Vie – Universidad de California
imagen: Imagen acreditada a los Institutos Nacionales de Salud
búsqueda original: acceso abierto.
«Evolución de alelos humanos específicos que protegen la función cognitiva de las abuelasPor Ajit Varkey et al. Biología molecular y evolución.
Resumen
Evolución de alelos humanos específicos que protegen la función cognitiva de las abuelas
El receptor mieloide CD33 (Siglec-3) suprime la reacción inmunitaria innata al reconocer un dominio extracelular del grupo V del ácido siálico (Sia) que contiene «patrones moleculares autoasociados» (SAMP). Mostramos previamente que el grupo V es deficiente en el dominio CD33El alelo alterado, alelos protectores de la enfermedad de Alzheimer de inicio tardío (LOAD), se deriva y asigna a la cepa de homínidos.
Ahora informamos múltiples mutaciones en el dominio CD33 V-set de homínidos. Debido a la mutación de pérdida de función fija del homínido en CMAH Gen, los humanos carecen norteÁcido glicolinoramínico (Neu5Gc), un ligando Sia preferido para CD33 ancestral. El análisis de mutación y las simulaciones MD indican que el cambio constante en el aminoácido 21 del dominio del grupo homínido V y los cambios conformacionales relacionados con His45 corrigieron la pérdida de Neu5Gc al cambiar a norteÁcido acetilneuramínico (Neu5Ac) – identificación.
Mostramos que los patógenos humanos Neisseria gonorrhoeae y grupo b Estreptococo se unen selectivamente a huCD33 como parte del mimetismo molecular inmune del huésped SAMP y que esta unión está significativamente influenciada por la modificación de los aminoácidos 21.
Además de CARGA protectora CD33 Alelos, los humanos albergan variantes de cognición derivadas, de toda la población y protectoras en varios otros loci. Curiosamente, 11 de 13 polimorfismos en estos genes humanos (incluyendo CD33) no son compartidos por los genomas de los antiguos homínidos: neandertales y denisovanos.
Presentamos un escenario evolutivo plausible para sintetizar, relacionar y comprender el conocimiento actual sobre la evolución de huCD33 y sugerir que la novedad surgió en humanos.

«Viajar ninja. Alborotador. Erudito del tocino. Experto en alcohol extremo. Defensor de los zombis».





More Stories
Actualización sobre el regreso al vuelo del Falcon 9 el sábado
La NASA está cerca de decidir qué hacer con la problemática nave espacial Starliner de Boeing
¿Las nueces son buenas para ti?